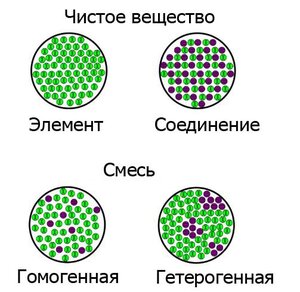
Ключевое различие между Гомогенным и Гетерогенным равновесием состоит в том, что в Гомогенном равновесии реагенты и продукты реакции находятся в одной фазе вещества, тогда как в Гетерогенном равновесии реагенты и продукты реакции находятся в разных фазах.
Равновесие — это состояние, в котором концентрации реагентов и продуктов остаются постоянными. Существует два типа равновесия вещества: Гомогенное равновесие и Гетерогенное равновесие. Эти два типа равновесия отличаются друг от друга фазой вещества реагента и продукта реакции.
Содержание
- Обзор и основные отличия
- Что такое Гомогенное равновесие
- Что такое Гетерогенное равновесие
- В чем разница между Гомогенным и Гетерогенным равновесием
- Заключение
Что такое Гомогенное равновесие?
Гомогенное равновесие — это состояние, в котором реагенты и продукты реакции находятся в одной фазе вещества. Как правило эти реагенты и продукты реакции находятся в едином растворе. Этот тип реакционной смеси называется гомогенной смесью. Химические частицы, которые находятся в этой смеси, могут быть молекулами, ионами или комбинацией молекул и ионов. Выражение для константы равновесия этого типа реакции включает концентрации всех реагентов и продуктов реакции. Например, смешение газообразного диоксида серы и газообразного кислорода дает газообразный триоксид серы, все реагенты и продукты находятся в газовой фазе. Тогда реакция и константа равновесия (К) будут следующими:
2SO2(g) + O2(g) ⇌ 2SO3(g)
K = [SO3(g)]2/[SO2(g)]2[O2(g)]
Что такое Гетерогенное равновесие?
Гетерогенное равновесие — это состояние вещества, в котором реагенты и продукты реакции находятся в разных фазах. В этом состоянии фазы могут быть любой комбинации: в твердой, жидкой или газообразной фазе. Однако, в отличие от гомогенного равновесия, при записи константы в гетерогенном равновесии необходимо исключать концентрации твердых веществ и чистых жидкостей. Например, смешивание углерода в твердой форме с газообразным кислородом приводит к образованию окиси углерода. Тогда реакция и константа равновесия (К) будут следующими:
O2(g) + 2C(s) ⇌ 2CO(g)
K=[CO(g)]2/[O2(g)]
В чем разница между Гомогенным и Гетерогенным равновесием?
Равновесие — это состояние, в котором концентрации реагентов и продуктов реакции остаются постоянными.
Существует два типа равновесий: Гомогенное равновесие и Гетерогенное равновесие. Ключевое различие между Гомогенным и Гетерогенным равновесием состоит в том, что в Гомогенном равновесии реагенты и продукты реакции находятся в одной фазе вещества, тогда как в Гетерогенном равновесии реагенты и продукты реакции находятся в разных фазах.
Кроме того, при определении константы равновесия для гомогенного равновесия необходимо включать концентрации всех реагентов и продуктов реакции; тогда как при определении Гетерогенных равновесий необходимо исключить концентрации твердых веществ и чистых жидкостей и использовать концентрации других реагентов и продуктов. В качестве примера, 2SO2(g) + O2(g) ⇌ 2SO3(g) является реакцией с Гомогенным равновесием, а O2(g) + 2C(s) ⇌ 2CO(g) является примером реакции с Гетерогенным равновесием.
Заключение — Гомогенное и Гетерогенное равновесие
Равновесие — это состояние, в котором концентрации реагентов и продуктов реакции остаются постоянными. Существует два типа равновесий: Гомогенное равновесие и Гетерогенное равновесие. Ключевое различие между Гомогенным и Гетерогенным равновесием состоит в том, что в Гомогенном равновесии реагенты и продукты находятся в одной фазе вещества, тогда как в Гетерогенном равновесии реагенты и продукты находятся в разных фазах. Кроме того, константа равновесия для Гомогенных равновесий включает концентрации всех реагентов и продуктов, в то время как константа равновесия для Гетерогенных равновесий должна исключать концентрации твердых веществ и чистых жидкостей.